研究内容
医療技術の発展は健康で安心して生活していくためには不可欠であり、医用高分子材料はナノメディシン・免疫療法・再生医療などの先端医療技術を下支えしています。児島研究室では、「強く」「優しく」「美しく」機能する医用高分子材料の設計・作製を行っています。
目指す研究
現在のバイオマテリアル研究では、既存の材料の改良や網羅的な検討によってより良い材料を作製していく手法が主流です。すなわち、目的の機能を発現させるバイオマテリアルを作製するための明確な設計指針がないのが現状です。児島研究室では、実際の医療に貢献できる材料の作製とともに、機能性バイオマテリアルの設計指針の構築を目指します。
医用高分子材料の研究は異分野融合研究です。児島は、高分子材料科学と分子生物学に関する研究背景をもっています。さらに、化学、物理、生物、医学など様々な分野の研究室との共同研究により、研究を進めていきます。
児島研究室では「好きこそものの上手なれ」をキーワードにしています。好きなことであれば、一見、大変と思われる作業でも自ら進んで、楽しく取り組むことができます。おもろいこと、夢中になれることを一緒に探しませんか。
デンドリマー
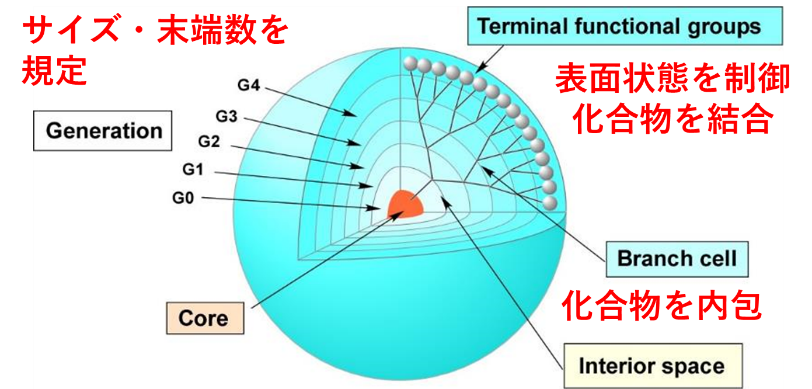
高分子は、医用材料によく用いられている材料です。蛋白質などの生体高分子は構造や配列を制御することができますが、合成高分子材料では分子量、組成、配列、構造を明確に規定できません。児島研究室では、デンドリマーと呼ばれる樹状高分子を用いています。デンドリマーは重合ではなく有機合成によって合成されるため、分子量、末端基、構造を明確に規定することができます。また、表面に存在する多数の反応性官能基に結合させたり、内部空間に内包させたりすることで、様々な化合物を導入することができるため、多機能性材料の作製が可能です(図1)。さらに、表面の末端基が高密度であるため、結合させた分子の集積効果も期待できます。このようなデンドリマーの特徴を生かすことで、機能性バイオマテリアルの作製を行うとともに、材料設計指針を得ることを目指しています。
具体的な研究内容
「強い」医用高分子
リンパ節・免疫細胞(T細胞)へのデリバリー ~免疫療法への貢献~
免疫は体を外敵から守るシステムです。近年、免疫細胞を活性化したり、病気の情報を教えることで病気を治療する免疫療法が注目されています。免疫療法は、自身の生体システムを使うので、人工物である薬物を用いた化学療法よりも副作用が小さい(優しい)治療法でもあります。
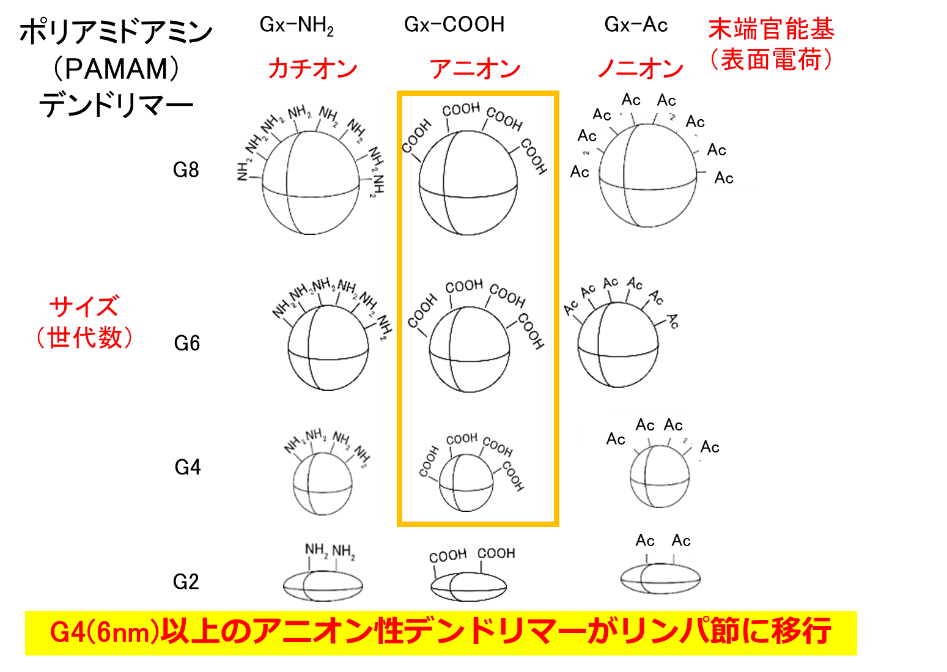
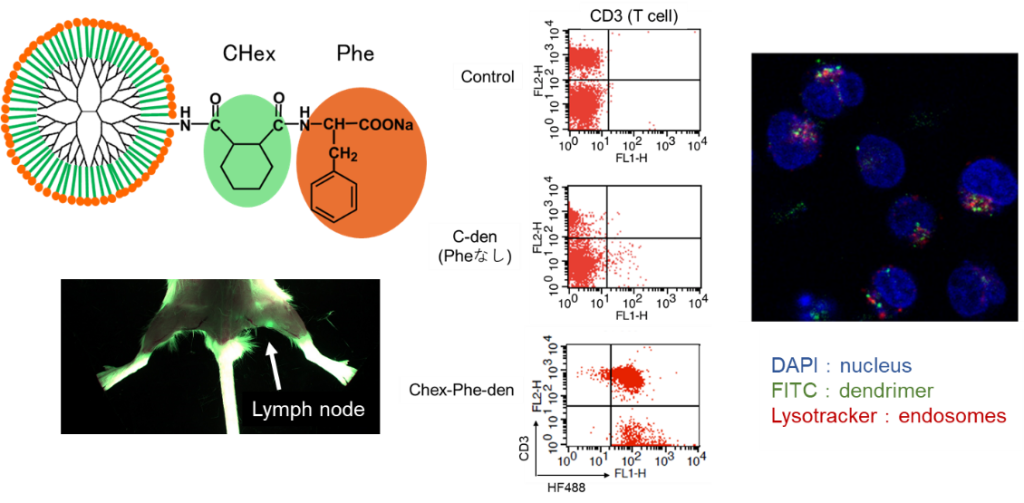
リンパ節には多くの免疫細胞が存在しているため、免疫の反応場になっています。リンパ節は小さい組織で、その内部に免疫細胞が集積しているため、大きな粒子は内部の免疫細胞まで到達しないと言われています。したがって、粒径が数nmのデンドリマーはリンパ節内の免疫細胞へのデリバリーに有用です。我々は、これまでの研究で、末端にアニオン性分子を修飾するとリンパ節に移行することがわかりました(図2)。また、末端の構造によって免疫細胞への取り込み挙動が異なることを示してきました。これまでの技術では、免疫反応で重要な役割を果たしているT細胞の内部へのデリバリーは難しかったですが、疎水性アミノ酸であるフェニルアラニン(Phe)を結合したカルボキシ末端のデンドリマーは、リンパ節内のT細胞に取り込まれることがわかりました(図3)。このデンドリマーの構造とT細胞への取り込み挙動との相関を調べるとともに、これらのデンドリマーを利用したT細胞への薬物・核酸デリバリーの研究を進めています。また、リンパ節に移行し、免疫細胞に取り込まれないデンドリマーはリンパ節に転移したがんへのドラッグデリバリー・イメージングに利用するための研究も行っています。
代表的な研究成果
- Y. Niki, C. Kojima, et al, Nanomedicine, 11, 2119-2127 (2015).
- H. Shiba, C. Kojima, et al, J. Mater. Chem. B, 10, 2463-2470 (2022).
Selected as the cover image of Volume 10, Issue 14, published on April 14, 2022. - Y. Nishimoto, C. Kojima, et al, Polymers, 12, 1474 (2020).
- C. Kojima, et al, Macromol. Biosci., 23, 2300139 (2023).
Selected as the cover image of Volume 23, Issue 141, published in November, 2023. - K. Nagai, C. Kojima, et al, Bioorg. Med. Chem. Lett., 33, 127726 (2021).
「優しい」医用高分子
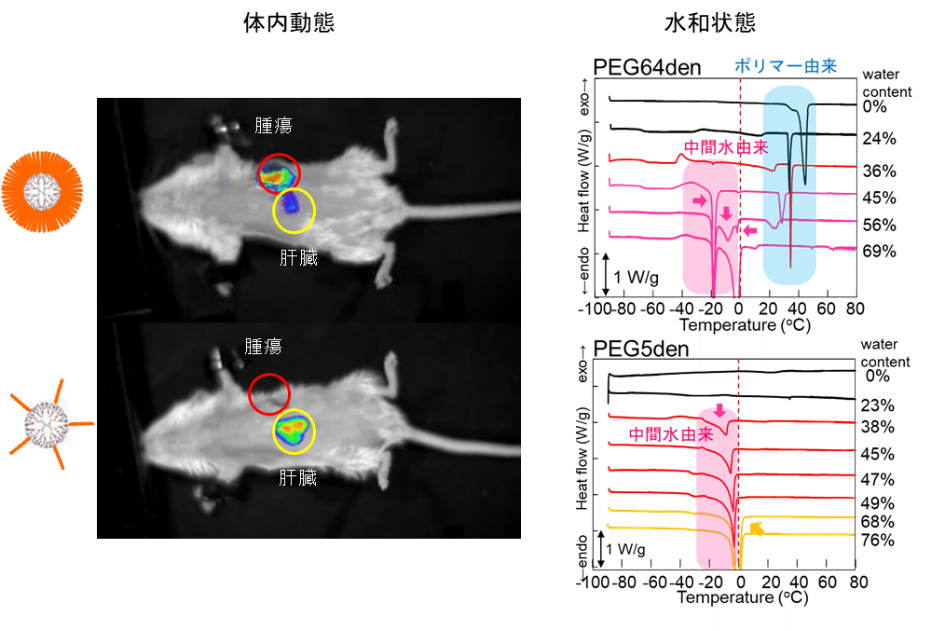
生体適合性ナノ粒子の腫瘍集積性と水和状態との相関 ~物性とデリバリー機能との相関~
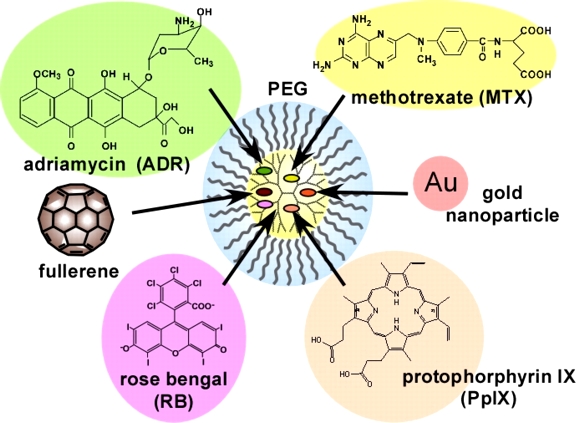
がんの化学療法で副作用を低減するには、腫瘍部位にナノ粒子を集積させる必要がある。正常部位と比較して、腫瘍部位で見られる新生血管は血管壁の隙間が大きいため、血中滞留性を示す生体適合性ナノ粒子は腫瘍との能動的な相互作用がなくても、受動的に腫瘍に集積することが知られている(これはEPR効果とよばれている)。生体適合性ナノ粒子はナノ粒子の表面に生体適合性高分子(ポリエチレングリコール(PEG)や双性イオン高分子など)を修飾することで作製されるが、その修飾率や鎖長によって血中滞留性は異なる。我々は、これまでの研究で、PEG修飾デンドリマーを作製し、様々な薬物を担持できること(図4)、血中滞留性を示すことを示してきた。また、結合数の異なるPEG修飾デンドリマーの水和状態を熱分析(DSC法)や分光法(FT-IR法)で調べたところ、水和状態が異なることがわかった。医用デバイスの高分子材料では、水和状態と生体適合性との相関があると言われている(中間水理論)。DDSナノ粒子であるPEG修飾デンドリマーでも水和状態と腫瘍への集積性が相関していることがわかった(図5)。鎖長・結合数・世代数の異なるPEG修飾デンドリマーを作製して、水和状態と体内動態の相関性について検証を進めている。
代表的な研究成果
- C. Kojima, et al, Bioconjugate Chem., 11, 910-917 (2000).
~25th anniversary collectionに選出。被引用回数500回以上~ - C. Kojima, et al, Int. J. Pharm., 383, 293-296 (2010).
- A. Tsujimoto, C. Kojima, et al, Mater. Sci. Eng. C, 126, 112159 (2021).
「美しい」医用高分子
pH・温度・光・酵素に応答する刺激応答性材料の作製 ~ナノメディシン、再生医療への展開~
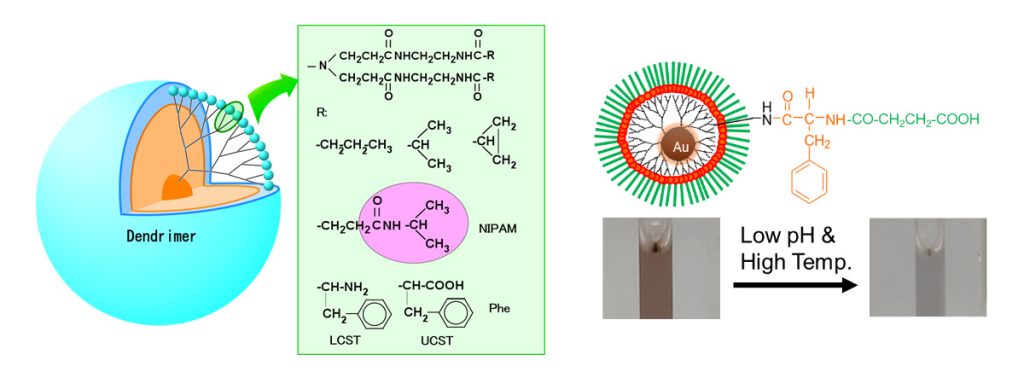
デンドリマーの末端にイオン性部位や疎水性部位を導入すると、pHや温度に応答する材料を作製することができます。また、酵素によって切断されるペプチドやたんぱく質を用いると、酵素に応答する材料を作製することもできます。さらに、金ナノ粒子を担持すると光応答性(粒径・凝集状態によって変化する表面プラズモン共鳴、X線散乱能、光発熱特性)を付与することができます。この光応答性はイメージングや光温熱療法に展開することができるため、金ナノ粒子を含む材料は治療と診断の両方(セラノスティクス)に使用することができます。さらに、様々な刺激応答性を組み合わせることで、刺激応答性DDS、がん転移に呼応したDDS、光照射による細胞分離材料、光学センサーなどの機能性材料を作製してきました(図6)。
代表的な研究成果
- Y. Haba, C. Kojima, Angew. Chem. Int. Ed., 46, 234-237 (2007).
- M. Tamaki, C. Kojima, RSC Advances, 10, 10452-10460 (2020).
- C. Kojima, et al, ChemNanoMat, 8, e202100442 (2022).
Selected as the cover image of Volume 8, Issue 3, published in March, 2022. - C. Kojima, et al, Macromol. Biosci., 17, 1600341 (2017).
- C. Kojima, et al, Acta Biomaterialia, 9, 5673-5680 (2013).
- Y. Umeda, C. Kojima, et al, Bioconjugate Chem., 21, 1559-1564 (2010).
- C. Kojima, et al, Nanotechnology, 21, 245104 (2010).
Highlighted in “nanotechweb”
人工蛋白質の作製 ~変性しない蛋白質~
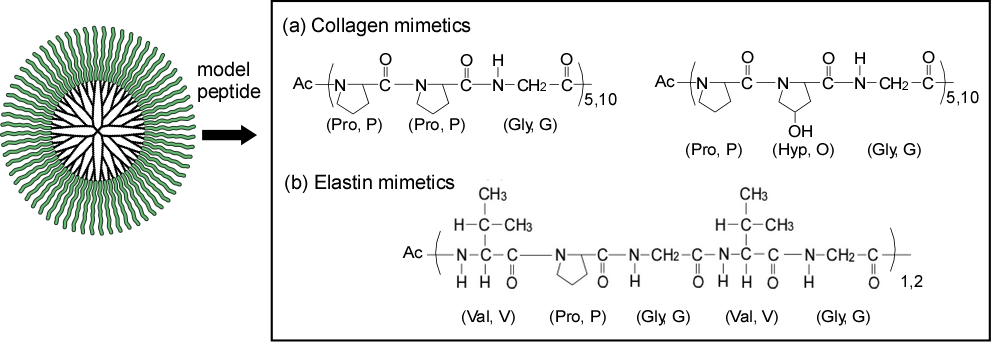
蛋白質は機能性材料として有用ですが、化学合成が難しく、pH・温度・溶媒によって変性して失活してしまうという欠点があります。蛋白質を同じサイズのデンドリマーの末端に蛋白質の部分構造であるペプチドやアミノ酸を結合させることで、人工蛋白質を作製しています。これまでにコラーゲン、エラスチン擬似分子を作製し(図7)、変性しない蛋白質模倣材料として機能することを示すだけでなく、デンドリマーコア部位の担持機能を活かしたDDSなどへの展開も行っています。
代表的な研究成果
- C. Kojima, et al, J. Am. Chem. Soc., 131, 6052-6053 (2009).
- C. Kojima, et al, Soft Matter, 7, 8991-8997 (2011).
- C. Kojima, et al, Biopolymers:Peptide Sci., 100, 714-721 (2013).
- D. Fukushima, C. Kojima, et al, Colloid Surf. B-Biointerfaces, 132, 155-160 (2015).
生体組織透明化 ~3次元組織イメージング~
組織は切片を作製して2次元的に観察されるのが一般的ですが、この方法では切片化することで3次元的な情報が失われてしまうため、全体像を把握することはできませんでした。そこで、組織を透明化し、そのままの形で3次元的に観察しようという試みがなされています。組織透明化には様々な方法がありますが、CLARITY法において用いられる高分子ゲルを改良する研究を行いました。イオン性高分子ゲル、特に、双性イオン構造をもつ高分子ゲルを用いるとより短時間で組織を透明化することができました。この手法は、がん治療・診断に利用できるのではないかと考えています。
代表的な研究成果
- C. Kojima, et al, Macromol. Biosci., 21, 2100170 (2021).
Selected as the cover image of Volume 21, Issue 9, published on September 18, 2021. - Y. Ono, C. Kojima, et al, J. Biomed. Mater. Res. B, 107, 2297-2304 (2019).


